PRACTICA 15: UNA UNIDAD FICTICIA “EL XOL”
INTEGRANTES DEL EQUIPO
PIRY HERRERA JASSO
-3cpiryherreraj16.blogspot.mx
KEVIN EDUARDO JIMENEZ ROMO
-3ckevinjimenezr.blogspot.mx
LEGNA CAROLINA LIRA AGUILA
-3clegnaliraA18.blogspot.mx
BRISSA ARANDEY LOPEZ REYES
PIRY HERRERA JASSO
-3cpiryherreraj16.blogspot.mx
KEVIN EDUARDO JIMENEZ ROMO
-3ckevinjimenezr.blogspot.mx
LEGNA CAROLINA LIRA AGUILA
-3clegnaliraA18.blogspot.mx
BRISSA ARANDEY LOPEZ REYES
-3cbrissalopezr19blogspot.mx
KATIA DEYANIRA LOPEZ SERNA
-3cKatiaLopezs20.blogspot.mx
GUILLERMO AXEL MACIAS MACIAS
FECHA DE REALIZACION: Miercoles 13 de Abril de 2016
KATIA DEYANIRA LOPEZ SERNA
-3cKatiaLopezs20.blogspot.mx
GUILLERMO AXEL MACIAS MACIAS
FECHA DE REALIZACION: Miercoles 13 de Abril de 2016
OBJETIVO:
Trabajar con una unidad ficticia “xol” para medir la cantidad de las sustancias.
HIPOTESIS;
Pensamos que el xol podia ser una unidad de medida muy precisa, exacta, verdadera y algo complicada de usar.
INVESTIGACIÓN:
Definición mol, su utilidad en Química.
EL MOL
Se conoce con el nombre de mol a una de las magnitudes físicas fundamentales que contempla elSistema Internacional de Unidades. Esta unidad se utiliza para medir la cantidad de toda clase de sustancias presentes en un determinado sistema.
El mol, cuentan los expertos, refleja la cantidad de sustancia que posee un número específico de entidades de carácter elemental como átomos se pueden hallar en doce gramos de carbono-12. Esto quiere decir que el número de unidades elementales (como el caso de átomos, moléculas o iones, por ejemplo) que se reflejan en un mol de sustancia es una constante que no guarda relación directa con el tipo de partícula o del material en cuestión. Dicha cantidad se conoce con el nombre de número de Avogadro.
Un personaje este, Conde de Quaregna y Cerreto, que además ejerció como profesor en la Universidad de Turín en el área de Física y que con dicha ley de Avogrado consiguió realizar una importante aportación a las ciencias. Básicamente con la misma lo que estableció fue que idénticos volúmenes de gases que se encuentran en las mismas condiciones, en lo que respecta a la temperatura y a la presión, contarán con el mismo número de partículas.
La ecuación señala que un mol equivale a 6,022 x 10 elevado a 23 partículas. Se trata de una cifra inmensa capaz de reflejar una enorme cantidad de partículas.
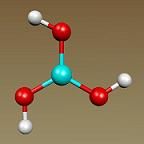

UTILIDAD DEL MOL EN QUIMICA
El concepto del mol es de vital importancia en la química pues entre otras cosas, permite hacer infinidad de cálculos estequiométricos indicando la proporción existente entre reactivos y productos en las reacciones químicas. Por ejemplo; la ecuación que representa la reacción de formación del agua 2 H2 + O2 → 2 H2O implica que dos moles de hidrógeno (H2) y un mol de oxígeno (O2) reaccionan para formar dos moles de agua (H2O).
Otros usos que cabe mencionar, es su utilización para expresar la concentración en la llamadamolaridad que se define como los moles del compuesto disuelto por litro de disolución y la masa molar, que se calcula gracias a su equivalencia con la masa atómica; factor de vital importancia para pasar de moles a gramos
El número de Avogadro, por lo tanto, ayuda a que los expertos en Química expresen el peso de los átomos.
La utilidad de este concepto de mol radica en que cuando consideramos reacciones químicas, las relaciones de masa de las sustancias reaccionantes quedan reducidas a números enteros que corresponden a la fórmula mínima.

Lee todo en: Definición de mol - Qué es, Significado y Conceptohttp://definicion.de/mol/#ixzz45wrKxwJm
https://www.google.com.mx/url?sa=t&rct=j&q=&esrc=s&source=web&cd=1&cad=rja&uact=8&ved=0ahUKEwiN3oeFypPMAhWpsIMKHSYKDZwQFggbMAA&url=https%3A%2F%2Fmx.answers.yahoo.com%2Fquestion%2Findex%3Fqid%3D20090204160149AAjcNmE&usg=AFQjCNF7U7P6FD4nsxyrh6U0hs17CQ65Xg&sig2=55oIuJ3ez66CArvAKVamfg&bvm=bv.119745492,d.amc
El mol, cuentan los expertos, refleja la cantidad de sustancia que posee un número específico de entidades de carácter elemental como átomos se pueden hallar en doce gramos de carbono-12. Esto quiere decir que el número de unidades elementales (como el caso de átomos, moléculas o iones, por ejemplo) que se reflejan en un mol de sustancia es una constante que no guarda relación directa con el tipo de partícula o del material en cuestión. Dicha cantidad se conoce con el nombre de número de Avogadro.
Un personaje este, Conde de Quaregna y Cerreto, que además ejerció como profesor en la Universidad de Turín en el área de Física y que con dicha ley de Avogrado consiguió realizar una importante aportación a las ciencias. Básicamente con la misma lo que estableció fue que idénticos volúmenes de gases que se encuentran en las mismas condiciones, en lo que respecta a la temperatura y a la presión, contarán con el mismo número de partículas.
La ecuación señala que un mol equivale a 6,022 x 10 elevado a 23 partículas. Se trata de una cifra inmensa capaz de reflejar una enorme cantidad de partículas.


UTILIDAD DEL MOL EN QUIMICA
El concepto del mol es de vital importancia en la química pues entre otras cosas, permite hacer infinidad de cálculos estequiométricos indicando la proporción existente entre reactivos y productos en las reacciones químicas. Por ejemplo; la ecuación que representa la reacción de formación del agua 2 H2 + O2 → 2 H2O implica que dos moles de hidrógeno (H2) y un mol de oxígeno (O2) reaccionan para formar dos moles de agua (H2O).
Otros usos que cabe mencionar, es su utilización para expresar la concentración en la llamadamolaridad que se define como los moles del compuesto disuelto por litro de disolución y la masa molar, que se calcula gracias a su equivalencia con la masa atómica; factor de vital importancia para pasar de moles a gramos
El número de Avogadro, por lo tanto, ayuda a que los expertos en Química expresen el peso de los átomos.
La utilidad de este concepto de mol radica en que cuando consideramos reacciones químicas, las relaciones de masa de las sustancias reaccionantes quedan reducidas a números enteros que corresponden a la fórmula mínima.

Lee todo en: Definición de mol - Qué es, Significado y Conceptohttp://definicion.de/mol/#ixzz45wrKxwJm
https://www.google.com.mx/url?sa=t&rct=j&q=&esrc=s&source=web&cd=1&cad=rja&uact=8&ved=0ahUKEwiN3oeFypPMAhWpsIMKHSYKDZwQFggbMAA&url=https%3A%2F%2Fmx.answers.yahoo.com%2Fquestion%2Findex%3Fqid%3D20090204160149AAjcNmE&usg=AFQjCNF7U7P6FD4nsxyrh6U0hs17CQ65Xg&sig2=55oIuJ3ez66CArvAKVamfg&bvm=bv.119745492,d.amc
https://www.google.com.mx/url?sa=t&rct=j&q=&esrc=s&source=web&cd=2&cad=rja&uact=8&ved=0ahUKEwiN3oeFypPMAhWpsIMKHSYKDZwQFggmMAE&url=https%3A%2F%2Fes.wikibooks.org%2Fwiki%2FQu%25C3%25ADmica%2FConcepto_de_mol&usg=AFQjCNHHZhA1dCtxtWYtndPMYYSPNakKvg&sig2=_XcQsK1Ta0LHJNO9cUhY1g&bvm=bv.119745492,d.amc
https://www.google.com.mx/url?sa=t&rct=j&q=&esrc=s&source=web&cd=3&cad=rja&uact=8&ved=0ahUKEwiN3oeFypPMAhWpsIMKHSYKDZwQFggsMAI&url=https%3A%2F%2Fes.wikipedia.org%2Fwiki%2FMol&usg=AFQjCNFKH2o9cSjWwr0s9lxGO4vF_oLjow&sig2=Mf00aXdc29_lOUxyHukQMQ&bvm=bv.119745492,d.amc
MATERIAL:
- Balanza granataria.
- 4 platos desechables
- Calculadora.
SUSTANCIAS:
- 1 taza de frijol.
- 1 taza de maíz palomero.
- 1 taza de lentejas
- 1 taza de garbanzos.
PROCEDIMIENTO EXPERIMENTAL
Iniciamos contando 1 xol (40 semillas) de cada semilla para pesarlo y ya después fuimos pesando los xoles que nos pedía la parte 2 y luego contar semilla por semilla para sacar nuestras conclusiones.
PROTOCOLO DE SEGURIDAD:
Esta practica no fue muy peligrosa solo teníamos que trabajar bien con la balanza y cuidarla aunque ya no funcionaba bien tratamos de trabajar con ella pero la maestra no la cambio.
No había peligro.
PROTOCOLO DE SEGURIDAD:
Esta practica no fue muy peligrosa solo teníamos que trabajar bien con la balanza y cuidarla aunque ya no funcionaba bien tratamos de trabajar con ella pero la maestra no la cambio.
No había peligro.
PROCEDIMIENTO:
- Con la balanza midan la masa de 40 semillas de cada sustancia y regístrenlo en la siguiente tabla:
Semilla
|
Cantidad
|
Masa (g)
|
Frijol
| 40 semillas | 13 .5g |
Maíz palomero
| 40 semillas | 9 g |
Lenteja
| 40 semillas | 1 g |
Garbanzo
| 40 semillas | 23 g |
NOTA: esta unidad de 40 elementos equivale a 1 xol.
- Con ayuda de la balanza y sin contar las semillas pongan en cada uno de las hojas:
- 3.5 xoles de frijol
- 0.5 xoles de garbanzos
- 2 xoles de lentejas
- 5 xoles de maíz.
- Predigan cuántas semillas debe de haber de cada sustancia de acuerdo al número de xoles que midieron y regístrenlo.
- Ahora sí cuenten el número de semillas que obtuvieron de cada sustancia y registren los datos.
Semilla
|
No. de xoles
|
Masa (g)
|
Semillas calculadas
|
Semillas obtenidas experimentalmente
|
Frijol
|
3.5
|
47.25 g
|
140
|
133
|
Maíz palomero
|
5
|
45 g
|
200
|
204
|
Lenteja
|
2
|
2 g
|
80
|
53
|
Garbanzo
|
0.5
|
11.5 g
|
20
|
21
|
OBSERVACIONES (IMÁGENES Y DESCRIPCIÓN)

aquí están las 40 semillas de cada semilla

cuando pesamos las lentjas

pesando las 40 semillas de maíz

pesando las 40 semillas de frijol

las 40 semillas de garbanzo

pesando los 3.5 xoles de frijol

la balanza que no nos funciono

la balanza que nos presto la maestra

pesando los 0.5 xoles de garbanzo

los 5 xoles de maíz palomero

los 2 xoles de lenteja

aquí están las 40 semillas de cada semilla

cuando pesamos las lentjas

pesando las 40 semillas de maíz

pesando las 40 semillas de frijol

las 40 semillas de garbanzo

pesando los 3.5 xoles de frijol

la balanza que no nos funciono

la balanza que nos presto la maestra

pesando los 0.5 xoles de garbanzo

los 5 xoles de maíz palomero

los 2 xoles de lenteja
ANÁLISIS:
- ¿Difiere el número de granos calculados con los obtenidos experimentalmente? ¿a que creen que se deba lo anterior? Un poco puede ser que podría existir una variante del peso de cada semilla ya sea aumentando o disminuyendo el peso
- Predice el número de semillas o de xoles que habrá según sea el caso:
- 5.5 xoles de maíz. 220 semillas
- 350 semillas de garbanzo. 8.75 xoles
- 0.3 xoles de lentejas. 12 semillas
- 9 semillas de frijol. 2.23 xoles
- ¿Consideran que el xol es una forma indirecta de contar cosas pequeñas? ¿Por qué?
Si, porque es una forma de representar la masa de algo(en este caso semillas) mediante esta unidad imaginaria aparte de ser algo imprecisa
CONCLUSIÓN:
CONCLUSIÓN:
Si logramos el objetivo pues durante todo el proceso se trabajo con el "xol" para medir la cantidad de semillas que se necesitaban.
Con esta practica aprendimos de alguna manera a usar la unidad ficticia del "xol" que en este caso representa 40 semillas representando en otra forma las moléculas de alguna sustancia.
Comprobamos que no fue muy difícil calcular la mas con esta unidad y aparte nos ayudo mucho la balanza (a pesar de que no servía bien).